

近日,专注于开发并量产微流控芯片的技术平台型公司「霆科生物」联合杭州德同生物技术共同推出了一个基于杂交捕获微流控技术的全自动核酸检测平台,该平台主要针对HPV核酸检测的靶标扩增技术的临床痛点,首次实现了14种高危型HPV免提取免扩增的全自动核酸分型检测。该平台由杭州德同生物技术主导,由霆科生物提供微流控芯片系统的设计、开发和测试服务。
宫颈癌是全球女性重大恶性肿瘤之一。目前世界已公认,高危型人乳头状瘤病毒(HPV)的持续感染是引起宫颈癌的主要病因。高危型HPV主要包括16、18、31、33、35、39、45、51、52、56、58、59、66和68型这14种。HPV核酸检测已经成为宫颈癌筛查的首选方案。现有传统HPV检测技术以靶标扩增技术(如PCR)为主,通过核酸提取和HPV片段(如L1区)扩增实现检测。但靶标扩增技术存在两大关键问题:一是样本处理和检测中容易产生气溶胶扩散引发交叉污染,导致假阳性;二是HPV基因在整合入人基因组时可能出现HPV部分核酸片段丢失,导致假阴性。
而该项基于杂交捕获微流控技术的全自动核酸检测平台由于杂交捕获微流控技术不涉及核酸扩增,因此避免了靶标扩增技术的假阳性问题。此外,该平台检测靶标为HPV全基因组,因此避免了扩增片段缺失可能导致的假阴性问题。该平台在四川省广元市中心医院进行临床样本的检测和验证,与现有获批宫颈癌筛查的HPV检测产品具有良好的一致性,展示了杂交捕获技术在临床应用的更多可塑性,为多重核酸分型检测提供了新的技术拓展和研究方向。
相关工作于2025年11月,以“Design and Development of a Target Amplification-Free Microfluidic Platform for Human Papillomavirus Genotyping: A New Generation of Hybrid Capture Immunoassay”为题,发表在《Journal of Medical Virology》期刊上。

相关研究工作
研究思路
本工作针对传统HPV检测技术的局限(如PCR易交叉污染,需专业实验室等),以“实现无靶标扩增、全流程自动化的高危HPV全分型检测”为核心目标,将杂交捕获核酸检测技术与微流控技术结合,设计了集成16组腔室和3条气动阀通道的微流控芯片,通过离心与气动阀控制实现液体四层级定向转移,完成杂交捕获全反应;同时搭配全自动检测仪器(含流体控制、温控、光电检测模块),无需核酸提取与靶标扩增,在单芯片上实现了14种高危型HPV分型检测。
临床验证阶段,以获批宫颈癌初筛的DH3 HPV检测产品为对照,通过927例临床样本(427例阳性、500例阴性)评估芯片的检测线性、分型一致性及筛查分流适配性,旨在为杂交捕获核酸检测技术提供更多的技术拓展,为全球HPV检测提供精准、便捷且适配不同应用场景(如基层诊所、即诊即治等)的技术方案。
研究结果
技术性能:微流控芯片可稳定完成杂交捕获全流程,检测14种高危型HPV质粒(浓度10-10000拷贝/μL)时线性良好,相关系数均大于0.99,且对低危HPV6、11无交叉反应;
临床一致性:与商品化DH3产品相比,微流控芯片总体一致性达97.52%(kappa=0.95),14种HPV分型一致性91.91%(kappa=0.87),宫颈癌初筛分流一致性93.31%(kappa=0.89),均呈极强一致性;
技术特性:芯片无需专业PCR实验室,全流程自动化,可在各类型医疗机构应用,且支持检测通道扩展(覆盖更多HPV亚型或其他病原体)。

图1通过(a)原理示意图、(b)结构示意图、(c)层状结构图三个子图,系统展示了微流控芯片的杂交捕获原理、核心结构设计及物理分层,为理解芯片的技术逻辑与功能实现提供关键视觉支撑。
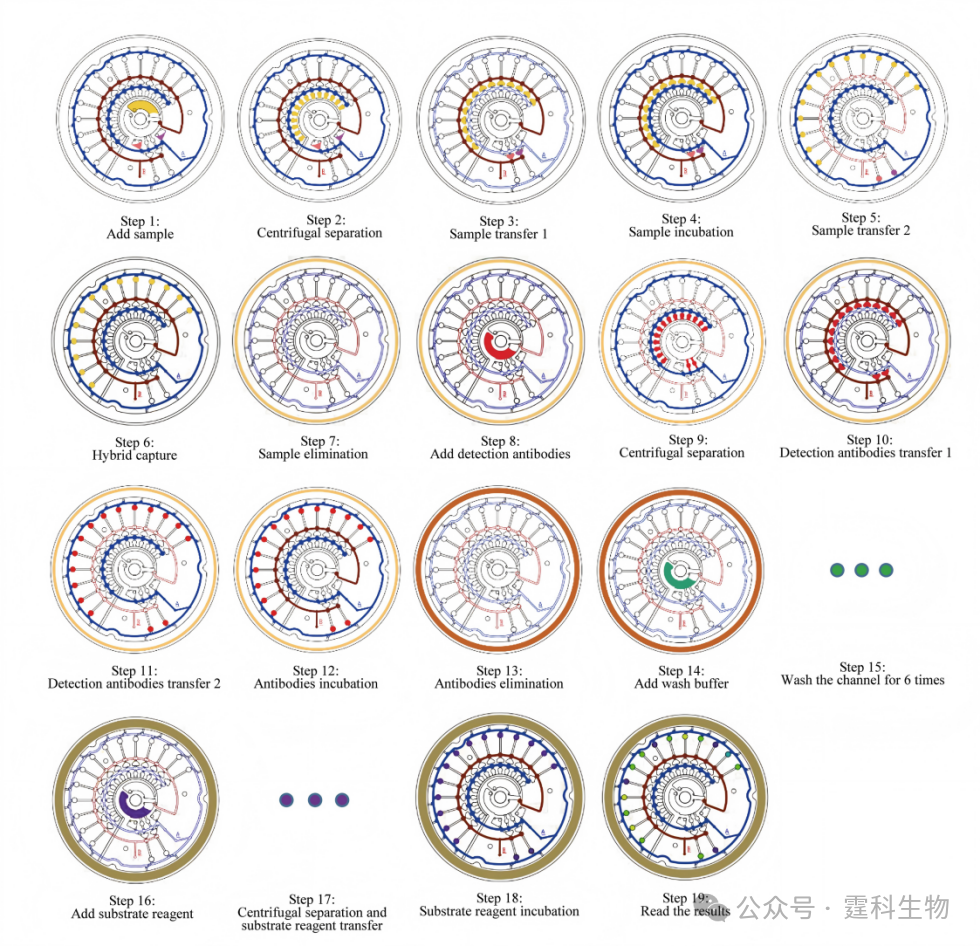
图2以步骤化流程图的形式,直观展示了样本、试剂在芯片内的全流程转移路径与阀门控制逻辑,清晰呈现了 “从样本加载到信号检测” 的整个过程,是理解芯片全自动化操作的核心依据。
结论
本项目成功开发出基于杂交捕获技术的免提取免扩增微流控芯片,首次实现单芯片对14种高危型HPV的全分型检测。杂交捕获微流控核酸检测技术规避了传统PCR检测技术的临床误诊和漏诊风险,兼具高精准度(临床一致性强)、高便捷性(全自动化)与广泛适配性(资源有限地区适用)。该技术不仅为宫颈癌精准筛查、风险分层提供有力工具,也为其他病原体的多重核酸检测提供技术参考,对推动全球核酸检测和提升基层医疗诊断水平都具有重要意义。
来源:霆科生物