

2024年4月30日,智新浩正创始人、中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)程新教授所带领的研究组与海军军医大学上海长征医院殷浩团队在国际学术期刊Cell Discovery联合发表了最新研究成果:“Treating a type 2 diabetic patient with impaired pancreatic islet function by personalized endoderm stem cell-derived islet tissue”。
该研究者发起的临床(IIT)研究首先利用患者自体血液PBMC重编程为iPSC,进而建立具有内胚层分化特异性的内胚层干细胞(Endoderm stem cell, EnSC),并以EnSC为种子细胞在体外再造胰岛组织(E-islet);最终于2021年7月19日,通过皮肝门静脉介入输注移植方式,治疗一例因终末期糖尿病肾病而接受过肾脏移植的、胰岛功能受损的2型糖尿病(T2D)患者。

Cell Discovery刊发该研究成果
这是世界范围内首次报道的(first-in-human)通过利用干细胞来源的自体再生胰岛组织移植治愈胰岛损伤性T2D的探索性临床研究。
该研究披露的术后116周数据初步证明了E-islet移植的安全性,并在血糖控制、外源胰岛素减量/脱离以及空腹/餐后的C肽/胰岛素分泌等关键临床指标方面证实了该组织替代治疗方法的显著有效性。
该研究首次在人体内证实,干细胞来源的再生胰岛组织可长期有效代偿T2D晚期患者的胰岛功能损失,逆转高血糖并实现功能性治愈。
糖尿病严重危害人类健康,也是多种疾病的重要诱发因素。胰岛功能损伤在糖尿病各亚型中均有不同程度的表现。
其中,2型糖尿病(T2D)患者随着胰岛β细胞数量逐渐减少并退化,其胰岛素分泌功能出现衰退现象,导致约30%的2型糖尿病患者须终身依赖于胰岛素注射治疗。
特别值得关注的是,血糖长期控制不佳会造成失明、肾脏衰竭、心脑血管意外、截肢、低血糖昏迷甚至死亡等严重并发症。
从2000年埃德蒙顿方案出现以来,从逝者捐献的胰腺中提取胰岛组织,并用于微创移植治疗包括脆性1型及2型糖尿病患者,取得了功能性治愈的突出疗效。
近年来,胰岛移植后5年完全脱离胰岛素患者的比例已上升到60%,其中一例患者甚至维持治愈长达20余年。
长期研究表明,胰岛移植有利于糖尿病肾病肾移植后患者的血糖控制,进而对移植肾的长期存活和功能维持具有积极意义。
然而,受制于供体的严重匮乏、胰岛分离技术复杂等因素的限制而难以推广。因而,在体外再造组织用于替代逝者捐献胰岛,对根治胰岛素依赖型糖尿病具有重大的应用价值和临床需求。
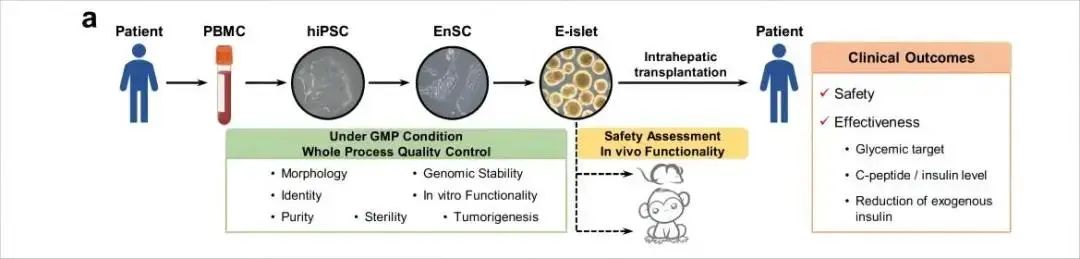
图1. 患者E-islet制备、质量控制及其移植安全性和有效性评估的主要流程概述
既往研究表明,利用多能干细胞定向分化可获得包括β细胞在内的胰岛内分泌细胞。
近期,Viacyte公司的临床I/II期研究表明胚胎干细胞体外定向分化来源的胰腺前体细胞(pancreatic progenitor cells)经非免疫隔绝的生物相容性包囊包裹后,经皮下移植后可以在T1D患者体内进一步分化为胰岛内分泌细胞,并响应饮食刺激分泌胰岛素;然而,由于胰腺前体细胞在体内进一步分化为β细胞的效率低下,该疗法尚无法提供足量的胰岛素使血糖恢复到健康水平。
此外,Vertex (Semma)公司利用胚胎干细胞来源的再生胰岛组织,于2021年7月26日也开展了移植治疗T1D的临床研究。
然而,以多能干细胞为原料制备胰岛组织面临极为复杂的分化中间过程带来的目标细胞纯度及非靶细胞存留问题,特别是体系内残留的未分化细胞带来的体内成瘤风险。
近年来寻找多能干细胞下游的、具有特异性分化潜能的、不具有体内成瘤性的干细胞新类型成为研究热点;其中,程新团队在世界上首次建立了系胚层特异性干细胞系——内胚层干细胞(EP cells)及其改良类型EnSC;EnSC在内胚层(胰腺、肝脏等)定向分化特异性及体内安全性方面具有优势,是体外规模化再造胰岛组织的优选种子。
在该研究中,程新团队建立了GMP条件下的体外定向分化体系,以患者自体EnSCs为种子,经过两个关键中间步骤,制备了在形态、内分泌细胞组成及比例、纯度、基因表达、体内外功能等方面与成体胰岛相近的再生胰岛组织E-islets。
研究团队利用免疫缺损SCID-beige小鼠模型、Streptozocin诱导的小鼠/食蟹猴糖尿病模型以及人源化小鼠模型分别评估了E-islet的体内存活、成瘤风险、体内功能及免疫原性(图2)。
在临床前的研究基础上,海军军医大学上海长征医院临床团队成功将120万胰岛当量(IEQ)的自体E-islets以经皮肝门静脉介入输注方式移植到患者肝脏内,定期观察安全性及有效性相关指标。
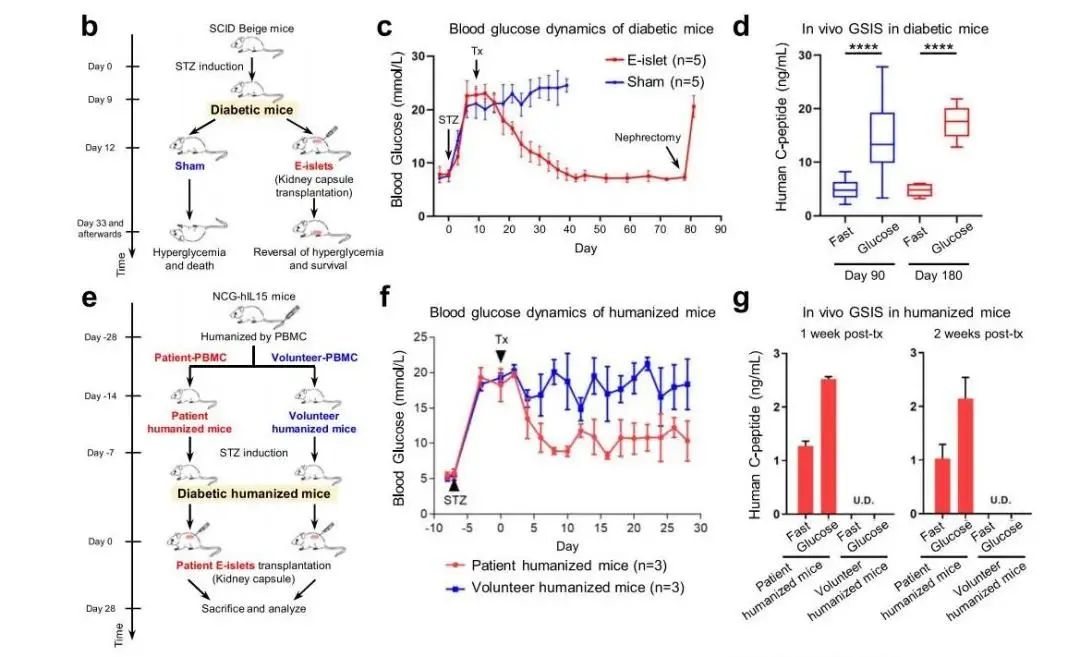
图2.T2D患者自体E-islet移植临床前研究结果
研究结果显示,E-islet移植后患者血糖控制随时间持续改善,24小时血糖实时监控设备的数据表明TITR(time-in-tight-range, 3.9~7.8 mM,也就是健康人的血糖波动范围)从术前的57%,一路上升,从 32周开始恢复到99%以上;严重高血糖(> 13.9 mM)和严重低血糖(<3.9 mM)在术后两周内完全消失;餐前餐后的血糖变异度(ambulatory mean glucose fluctuations)从术前的5.50 mM 下降到32周的1.60 mM。
此外,严格馒头餐实验(mixed-meal tolerance test, MMTT) 揭示术后稳定的餐前血糖水平以及餐后血糖变化幅度的显著降低(从术前最高21.3 mM 降低至第105周的9.1 mM)。
与血糖数据一致的是,糖化血红蛋白水平从术前6.6% 下降至第113周的4.6%。
同时,患者从术后第11周开始完全脱离外源胰岛素,其他降糖药(拜糖平、二甲双胍)术后逐步减量,并在第48周和56周实现脱离。最后,患者术后空腹C肽水平较术前增加了2倍;MMTT实验揭示餐后胰岛素及C肽分泌较术前均显著增加,提示胰岛功能恢复(图3)。
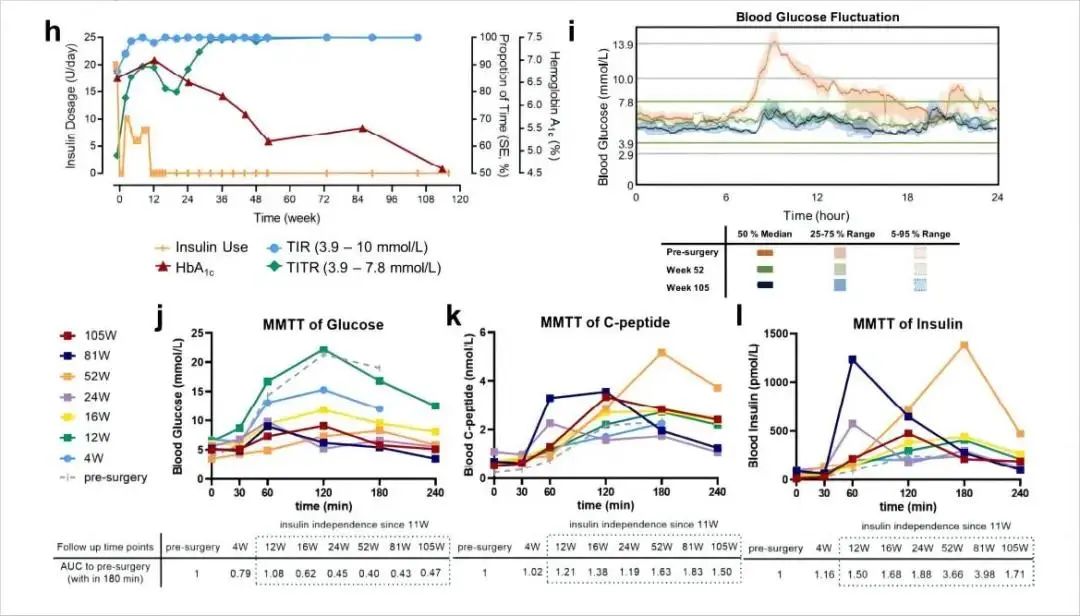
图3. T2D患者自体E-islet移植临床研究结果
特别值得指出的是,在糖尿病适应症的选择上,该研究具有特色。作为系列探索性临床研究的首例,研究团队特意挑选一位有25年T2D病史的60岁患者,该患者在2017年因糖尿病引起的肾功能衰竭接受了肾移植,术后血糖控制不良,每天需注射超过20单位胰岛素并服用多种降糖药物。如果血糖控制持续不佳,该患者在随时面临低血糖带来的风险的同时也面临短期内肾脏功能再次衰竭的可能,因此该患者属于胰岛移植的刚需人群。这一适应症选择不仅有利于在规避异体排异因素影响的条件下评估E-islet体内安全性及有效性,更是拓宽了干细胞来源的再生胰岛的临床应用场景。
研究者提示未来的研究方向将聚焦:干细胞来源的再生胰岛组织作为临床药物的药效学等研究、适应症的进一步拓展以及开发无需免疫抑制的“通用型”再生胰岛组织的制备技术。
分子细胞卓越中心吴佳颖、付天龙、聂螣騛、魏同坤和海军军医大学李拓、郭猛、季俊松、孟小茜为该论文共同第一作者。分子细胞卓越中心程新研究员、海军军医大学上海长征医院殷浩教授、石勇铨教授、董伟华教授和上海仁济医院张明教授为该论文的共同通讯作者。该项工作得到了中国科学院战略性先导科技专项、国家科技部重点研发计划、国家自然科学基金、上海市科委以及申康项目的基金支持。该研究得到分子细胞卓越中心动物平台、细胞平台和分子平台的大力支持。
来源:中国科学院分子细胞卓越中心