

2024年1月1日,复诺健宣布,公司新一代以转录翻译双重调控为基础的非减毒骨架HSV-1溶瘤病毒产品VG201(产品代码VG2025)获得国家药品监督管理局药品审评中心临床试验默示许可,批准其在中国开展针对晚期实体瘤的静脉注射临床试验。
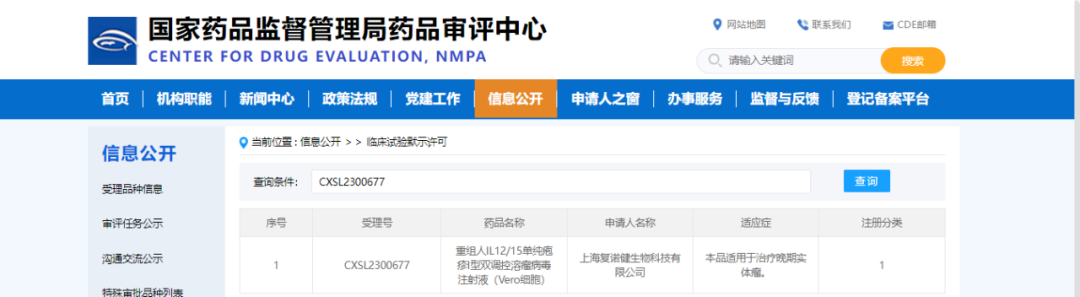
复诺健获得的2024年LP00001号临床批件,是中国CDE药监部门今年发出的第一张临床批件,也代表着复诺健一直深耕在溶瘤病毒药物领域所取得的又一次突破和里程碑。

VG201本次IND申报获得CDE批准,是继2022年1月获得美国FDA及2022年4月获得中国瘤内注射临床试验批准之后,在探索静脉注射给药方式方面取得的重要进展,为产品提供了更加广阔的临床应用前景。VG201在前期瘤内注射人体临床试验中,显示了出色的安全性。
众所周知,相对于局部瘤内注射给药方式,系统给药的静脉注射方式操作方便;但对于溶瘤病毒本身的安全性和有效性也面临着更大的挑战。
VG201在临床前静脉注射研究中,不仅通过详实的数据展示了良好的安全性;而且,在静脉给药方式治疗过程中,克服了血液稀释的挑战,充分利用静脉给药的高效递送方式,通过肿瘤选择性病毒复制、直接溶瘤作用及其表达的IL-12,IL-15/IL15Rα细胞因子刺激机体免疫系统,有效地抑制了原发病灶肿瘤生长和扩散转移,彰显出VG201在开发原发性肿瘤及转移瘤治疗手段方面的优势和巨大潜力。
VG201是基于复诺健独家拥有的TTDR骨架构建的First-in-class HSV-1溶瘤病毒产品,对特异性表达癌胚抗原(CEA)的肿瘤具有增强的溶瘤活性,并表达免疫刺激细胞因子IL-12和IL-15/IL15Rα ,进而调节肿瘤微环境。
此外,VG201有望成为首个基于肿瘤生物标志物的靶向性溶瘤病毒。
目前,VG201已经在中国和美国分别开展瘤内注射一期临床试验,此次静脉注射给药方式获批临床试验后,将为开拓更多适于静脉注射的肿瘤适应症创造条件,为癌症患者提供更加有效的临床治疗方案,以期取得更优的治疗效果。
来源:复择纳生物 Fraserna