

近年来,中国很多科技领域发展迅速,医疗、半导体、人工智能等领域掀起了持续的自主创新热,从技术创新到人才培养到产业化生态打造等形成立体化的推进。在生物技术方向,我们则看到基因编辑、合成生物学等诸多热门细分领域正呈腾飞之势,其相关技术的自主创新与应用持续加速推进,人才流动趋势也由外向内。
就在日前,科技部发布了国家重点研发计划《“前沿生物技术”重点专项2022年度项目申报指南(征求意见稿)》(以下简称“《指南》”)征求意见通知,这是在国家政策层面引导并鼓励青年科学家在生物技术领域加强前沿基础科学探索。
根据《指南》,国家前瞻性布局并引导的技术方向有21个,这些方向从大的维度可归纳为生命基本物质和生命核心过程的解析、调控与合成技术研究,开展生物技术领域关键装备与工具研发,布局原创的未来生物技术重大创新产品3大任务板块。其中,“生命过程的调控与解析”板块细分14个技术方向,“组学”、 “单细胞”和“基因”在该板块高频出现,意味着“组学”、 “单细胞”和“基因”为《指南》的重点引导方向,同时提示相关领域的从自主创新到应用的发展趋势及其可能衍生的投资机会。
对于生物技术的发展和创新,尽管中美之间发展起点和进程不同,但双方间隙在缩小。相信在未来几年内,依托于国家层面的引导和科学界、产业界的协同,相关领域生物技术会沿着自主创新路径取得一系列的技术落地成果。作为加快技术落地走向产品化、助推产品研发走向产业化的资本角色,磐霖也相信这一系列细分领域中,依托于快速成长的科研和工业团队,自主创新将使得中国诞生出best-in-class/first-in-class相关产品和投资的系列机会。
接下来我们则从生物技术自主创新视角,针对指南所引导的技术方向做相关探讨和解析。
《指南》明确该重点专项总体目标为“以全球化视野统筹资源和要素,突破一批颠覆性前沿生物技术,提升我国生命科学与前沿生物技术原始创新能力,构建生物技术体系基本框架”。
根据《指南》,国家前瞻性布局并引导的技术方向有21个,这些方向从大的维度可归纳为生命基本物质和生命核心过程的解析、调控与合成技术研究,开展生物技术领域关键装备与工具研发,布局原创的未来生物技术重大创新产品3大任务板块。其中,“生命过程的调控与解析”板块细分14个技术方向,“组学”、 “单细胞”和“基因”在该板块高频出现,意味着“组学”、 “单细胞”和“基因”为《指南》的重点引导方向,同时提示相关领域的从自主创新到应用的发展趋势及其可能的投资机会。
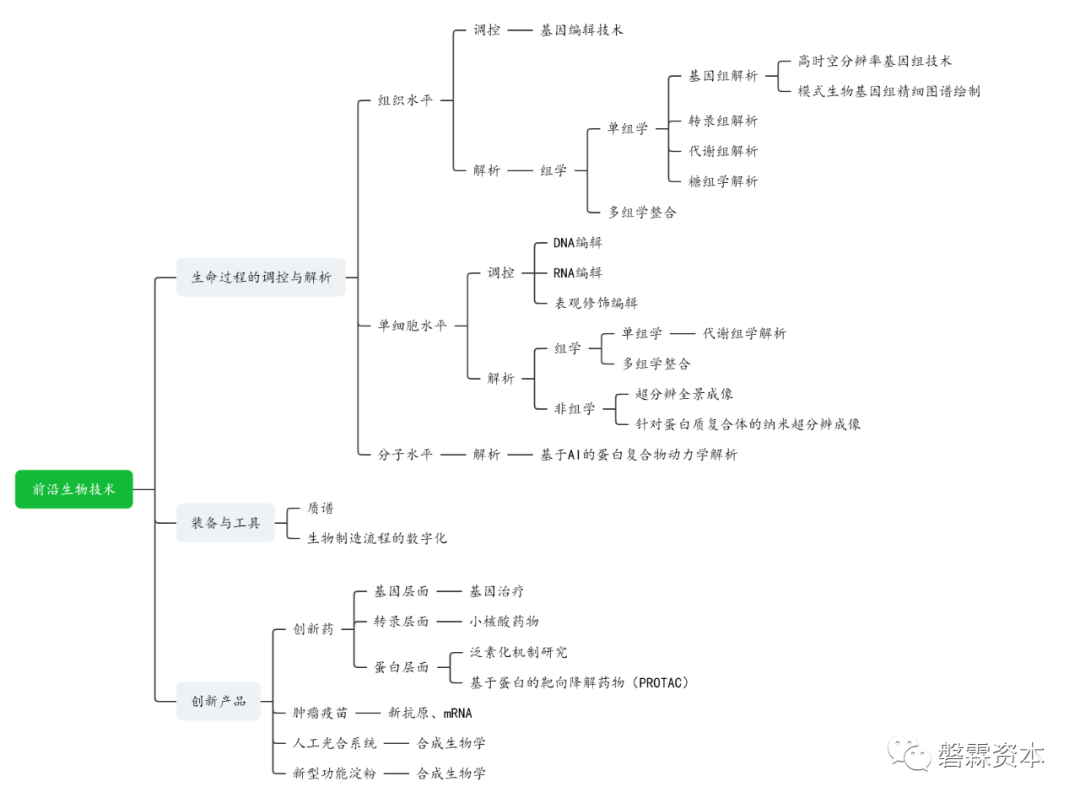
《指南》涉及的技术方向一览
在上述技术方向中,磐霖生物医药团队选择了具有想象空间并处于落地进程中的细分领域,进行逐一解读,具体包括:组学解析,单细胞表征,基因编辑,AI制药和合成生物学。
组学是生物体内某一类物质的集合。生命过程依靠“中心法则”,依次由DNA、RNA、蛋白质进行信息的传递。对基因组学、转录组学、蛋白质组学、代谢组学以及糖组学等的解析,是认识生命和疾病进程的重要方法。
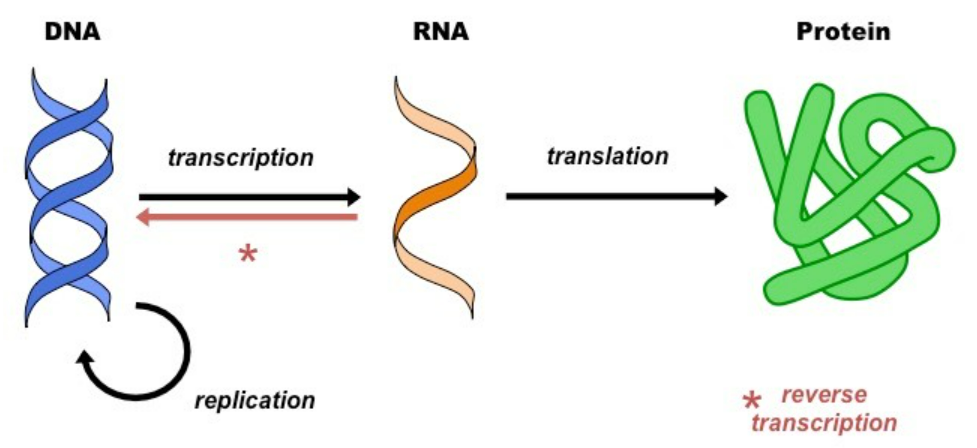
生命过程基于中心法则
其中,高解析能力是准确认知的关键,《指南》主要引导两个发展方向:
* 高通量、高灵敏度、高精准度的定性和定量单组学分析技术
* 多维组学的整合
组学解析的本质是复杂生物信息的全面检测和解码。《指南》在细分领域中重点提及基因组学、转录组学、代谢组学和糖组学的解析,从基础认知和技术开发层面加以推进,未来这些组学领域也将走向自主创新应用层面。
以糖组学为例,作为组学的重要维度之一,正逐渐受到学术界和产业界的关注。聚糖是四种基础生物大分子之一,其他三种包括核酸、蛋白质和脂类。
首先,聚糖是重要的信息分子,几乎覆盖了生物有机体的所有细胞。在生命活动中,糖链参与了细胞间通信、免疫功能发挥、信号传导等过程。因此,对聚糖信息的解析可为疾病的理解提供更丰富的证据,而聚糖结构天然的多样性和复杂性则对当前的解析技术提出了更高的要求。

聚糖的结构呈现多样性和复杂性
根据《指南》的引导,未来糖组学技术可能有如下的发展方向:
* 糖链化学和生物标记试剂的开发
* 糖链的富集和分离技术的开发
* 糖链和糖蛋白的质谱分析技术的开发
* 人类高发肿瘤糖链、糖基化位点和糖基化蛋白质表达谱的建立
细胞是构成生物体的基本单元。而单细胞表征能够揭示单个细胞独有的组学特征、形态甚至复合物的结构,有助于深入认识疾病。根据《指南》,未来的单细胞表征主要有两个发展方向:
* 组学方面,包括代谢组学以及多维组学的解析
* 成像方面,包括超分辨全景成像和针对蛋白质复合体的纳米超分辨成像

未来的单细胞表征两大方向
从技术落地视角看,单细胞表征当前的落地场景为疾病诊断和基础研究。高通量单细胞多组学检测平台可实现病理样本的高效分析,目前该领域已经诞生了相关的创新企业。
在未来,随着技术的进步和需求的驱动,我们相信会有这样的公司诞生并会获得市场认可,他们将在通量、灵敏度、准确度、多维组学整合方面实现突破。
自上世纪八十年代以来,基因编辑技术开始不断演进,依次发展出了ZFNs (zinc-finger nucleases)技术、TALENs(transcriptioin activator-like effector nucleases)技术、CRISPR/Cas9技术、单碱基编辑技术(base editing, BE)和先导编辑技术(prime editing, PE),而CRISPR/Cas9技术因其简便性和成熟性是当下广泛使用的基因编辑工具。
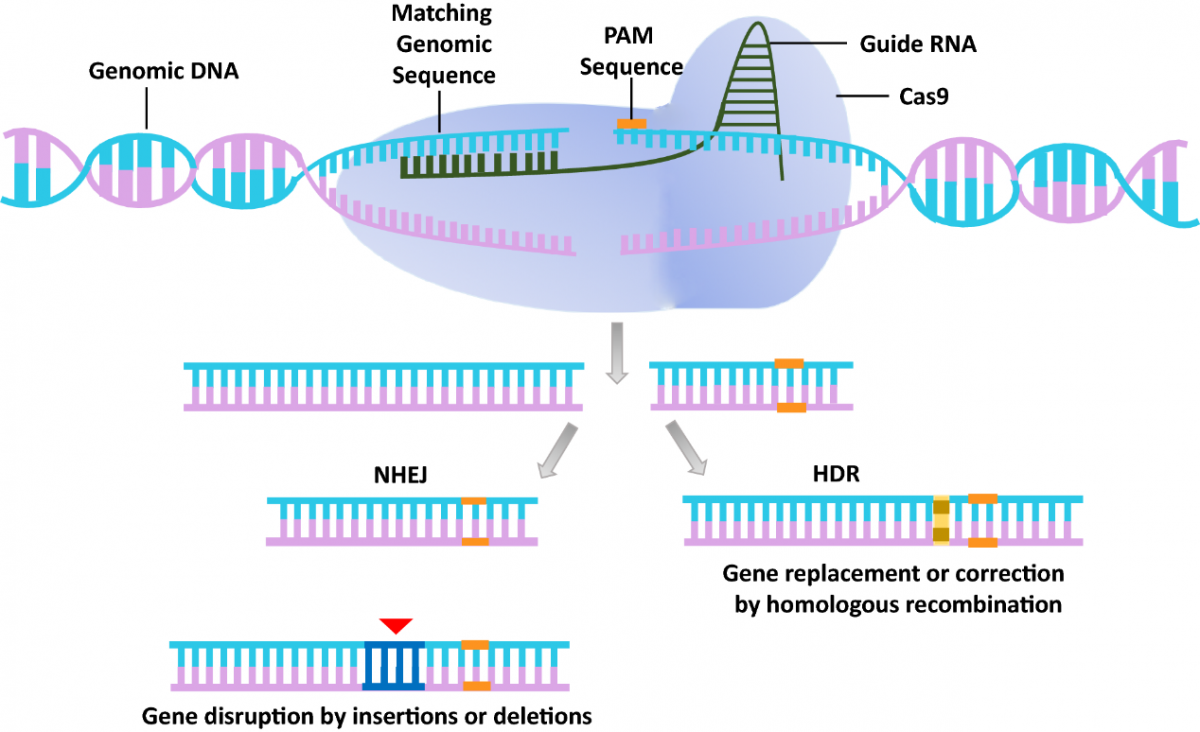
CRISPR/Cas9的原理
就应用场景来看,基因编辑可分为体外编辑和在体编辑。在体外编辑中,常用第一代基因编辑技术(基于DN双链断裂的靶基因敲除或敲入),可解决当前细胞疗法的免疫排斥或免疫抑制问题,如通用型免疫细胞、通用型干细胞等。在体编辑中,则利用递送系统(如LNP)将基因编辑工具递送至靶组织,治疗基因突变引发的疾病,如转甲状腺素淀粉样变性。

基因编辑的体外编辑和在体编辑
当前,基因编辑技术主要面临脱靶效应、编辑效率低、 PAM限制等问题,技术上尚有完善空间,同时基因编辑技术由实验室端到落地的周期相对较短,研发实力强劲的实验室可不断实现技术转化,值得关注。在技术层面,基因编辑工具的优化和衍生技术的开发或将是整个细分领域发展的关键,比如:
* 全新的基因编辑体系
* 更优的CRISPR体系:Cas蛋白改造、碱基脱氨酶改造等
* 基因编辑衍生技术:表观修饰编辑工具等
大多数疾病的发生、发展与蛋白质的异常有关,而异常的蛋白可作为治疗疾病的靶点。同时,蛋白质的形态在体内是动态变化的。AI技术通过对已采集数据的解析和自我训练,可不断提升对蛋白质形态预测的准确度,从而基于靶点信息设计相应的大分子或小分子药物,提升药物开发的效率和成功率。
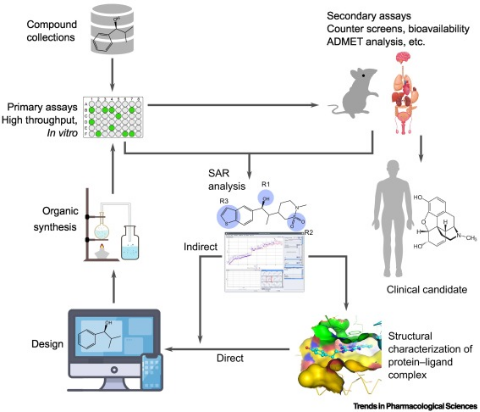
AI辅助药物研发的流程
药物研发是一个系统性工程,其基本流程为:靶点发现、药物筛选和确认、临床前研究、临床研究、申报上市。现阶段的AI制药多数集中于前两个环节,即发现新的靶点和在靶点确认条件下筛选最合适的药物形式,而后者技术上相对容易切入。
目前,AI制药面临的问题是“无法自证”,全球进展最快的管线为BioXcel公司的BXCL501,现处于临床2期。国内仅有英矽智能的ISM001-05于2021年12月进入临床(澳大利亚开展)。在资本市场上,当前AI制药领域逐渐回归理性,而头部公司的进展起着风向标的作用,若BXCL501的临床2期取得成功,则可能会引发下一轮投资热潮。
合成生物学是以工程学思想为指导,按照特定目标理性设计、改造乃至从头重新合成生物体系,用以解决能源、医学、食品、农业等各方面的问题。
合成生物学的整个生产链条可分为原料选择、底盘细胞的选择和优化以及产品生产3个部分,其中的核心工作是底盘细胞的选择和优化。
基因编辑的体外编辑和在体编辑
在合成生物学领域,《指南》主要引导人工生物叶片和糖苷键重构(秸秆制淀粉)两个方向。天然光合系统面临吸收光谱窄、电子传递链复杂等问题,设计构建更加高效的人工光合系统具有重要的现实意义。具体的发展方向有:
* 建立5种以上新型人工纳米器件、人工光合细胞和体外杂合体系,实现可见光的全光谱吸收
* 人工光合系统综合太阳能利用效率是天然光合系统的10-20倍,达10%-20%
* 建立光能驱动的生物固碳、生物产氢与复杂化学品合成的颠覆性路线
糖苷键重构方面,秸秆的高效利用和新型功能淀粉的开发存在广泛需求,挖掘和改造糖苷酶、糖基转移酶、多糖磷酸化酶、多糖修饰酶等关键酶可为该领域提供有力工具。具体的发展方向有:
获得具有高催化效率的糖苷酶、聚糖酶、糖基转移酶和修饰酶共50个以上,并解析5个以上低聚糖合成关键酶的蛋白质结构;
* 开发2~3个以上能够利用单体 UDP 纤维素或和淀粉生成 UDP-葡萄糖的糖基转移酶;
* 构建5种以上功能性低聚糖合成的人工多酶体系,实现纤维素转化率超过50%;
* 秸秆制淀粉实现产业化示范。
本文由磐霖资本研究整理